8月26日,國(guó)家藥監局發布《醫(yī)療器械唯一标識系統規則》(以下簡稱《規則》),旨在貫徹落實《國(guó)務(wù)院辦公廳關于印發治理(lǐ)高值醫(yī)用(yòng)耗材改革方案的通知》(國(guó)辦發〔2019〕37号)和《醫(yī)療器械監督管理(lǐ)條例》,進一步加強醫(yī)療器械全生命周期的監督管理(lǐ),創新(xīn)監管模式。《規則》共18條,明确了醫(yī)療器械唯一标識系統建設的目的、适用(yòng)對象、建設原則、各方職責和有關要求,自2019年10月1日起正式施行。
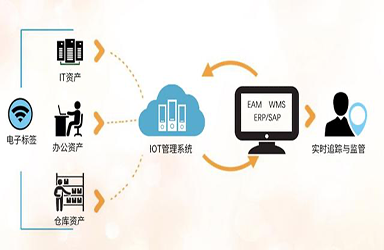
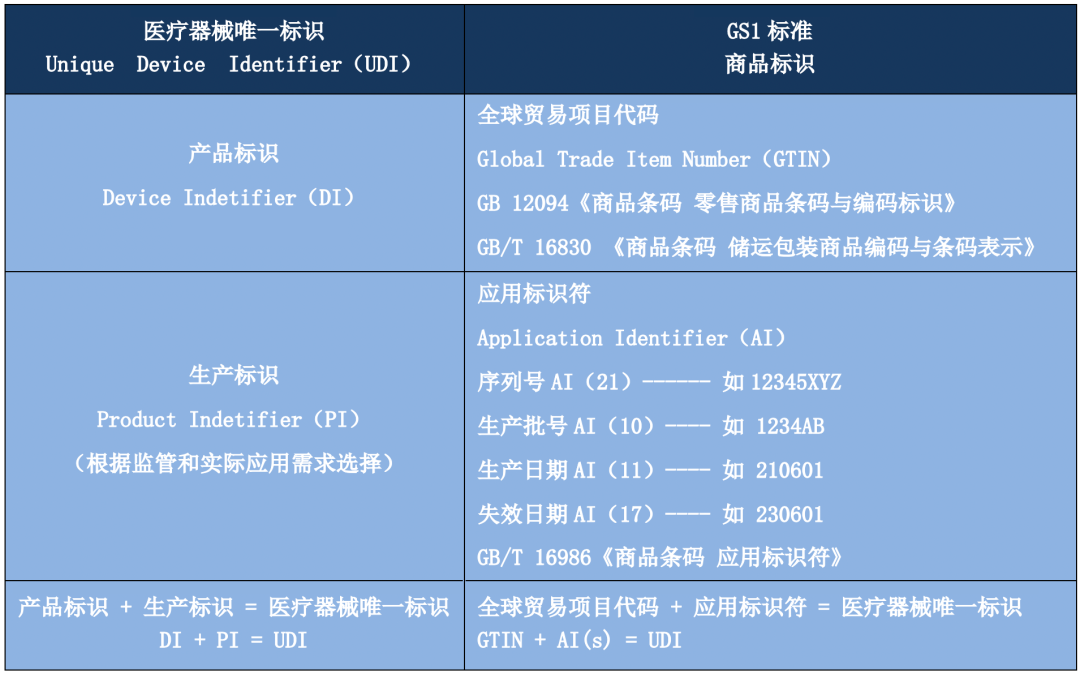
醫(yī)療器械唯一标識(Unique Device Identification,簡稱UDI)是醫(yī)療器械産品的電(diàn)子身份證,唯一标識數據載體(tǐ)是儲存或者傳輸醫(yī)療器械唯一标識的媒介,唯一标識數據庫是儲存醫(yī)療器械唯一标識的産品标識與關聯信息的數據庫,三者共同組成醫(yī)療器械唯一标識系統。通過建立醫(yī)療器械唯一标識系統,有利于運用(yòng)信息化手段實現對醫(yī)療器械在生産、經營和使用(yòng)各環節的快速、準确識别,有利于實現産品監管數據的共享和整合,有利于創新(xīn)監管模式,提升監管效能(néng),有利于加強醫(yī)療器械全生命周期管理(lǐ),實現政府監管與社會治理(lǐ)相結合,形成社會共治的局面,進一步提升公衆用(yòng)械安(ān)全有效的保障水平。
《規則》明确規定唯一标識應與産品基本特征相關,必須符合唯一性、穩定性和可(kě)擴展性的原則。為(wèi)更好地落實發碼機構相關職責要求,《規則》規定發碼機構應當為(wèi)中國(guó)境内的法人機構,并要求發碼機構應當向注冊人/備案人提供執行其标準的流程并指導實施,将編碼标準上傳至醫(yī)療器械唯一标識數據庫并動态維護,每年1月31日前向國(guó)家藥監局提交按照其标準創建的唯一标識上一年度的報告。《規則》規定國(guó)家藥監局負責組織建立醫(yī)療器械唯一标識數據庫,供公衆查詢,數據的真實性、準确性和完整性對于醫(yī)療器械的正确識别至關重要,《規則》強調了醫(yī)療器械注冊人/備案人應當對數據的真實性和準确性負責。
醫(yī)療器械唯一标識的價值在于應用(yòng),各環節的有效應用(yòng)是形成監管大數據的基礎,是實施互聯網+監管、智慧監管的重要途徑和手段,因此《規則》鼓勵各相關方積極在醫(yī)療器械生産、經營和使用(yòng)環節的管理(lǐ)中應用(yòng)醫(yī)療器械唯一标識。
《規則》的發布實施,将進一步規範醫(yī)療器械唯一标識系統建設,加強醫(yī)療器械全生命周期管理(lǐ),提高醫(yī)療器械識别的準确性和一緻性,提升醫(yī)療器械管理(lǐ)水平和效能(néng),有力保障公衆用(yòng)械安(ān)全有效。